NephrESA
Ein systembiologischer Ansatz gegen renale Anämie
Weltweit leiden 109 Millionen Patienten mit chronischen Nierenerkrankungen (chronic kidney disease, CKD) an Blutarmut. Die Häufigkeit von CKD nimmt in einer alternden Bevölkerung rapide zu. Die abnehmende Funktionalität der Niere bei CKD verursacht eine anhaltende Entzündung und führt deswegen zu einem effektiven Eisenmangel sowie einer Beeinträchtigung der Erythropoietin-(Epo)-Sekretion. Diese beiden Faktoren beeinträchtigen die Fähigkeit zur Erneuerung der roten Blutkörperchen und führen damit zu Blutarmut (Anämie). CKD-Patienten unterscheiden sich in ihren Entzündungswerten und ihrem Eisenstatus und weisen starke Schwankungen im Hämoglobinspiegel auf. Patienten mit Anämie werden mit Erythropoese-Stimulatoren (ESAs), Derivaten von Epo, behandelt. Die ESA-Behandlung nach den aktuellen Leitlinien für CKD-Patienten berücksichtigt keine individuellen Patientenunterschiede. Ein zu schneller Anstieg der Menge an roten Blutkörperchen aufgrund hoher ESA-Dosen führt jedoch zu erhöhten Scherkräften im Blut und damit zur Aktivierung der Blutplättchen. 40% der CKD-Patienten im Stadium G4 bergen ein hohes Risiko für thrombovaskuläre Erkrankungen, wie Thrombose, Herzinfarkt oder Schlaganfall mit häufig tödlichen Folgen. Dieses Risiko ist in Stadium G5 noch höher. Um die Auswirkungen patientenspezifischer Unterschiede in der renalen Anämie zu analysieren, werden wir das zuvor entwickelte Mechanismus-basierte Multiskalenmodell für chemotherapie-assoziierte Anämie bei Lungenkrebs re-kalibrieren, das die Interaktion von Epo mit seinem Rezeptor in den Vorläufern der roten Blutkörperchen quantitativ beschreibt. Die Ausgangsparameter des mathematischen Modells wurden auf der Grundlage von Daten aus klinischen Studien bei Lungenkrebs ermittelt und werden, basierend auf klinischen Studien bei CKD, re-kalibriert. Darüberhinaus werden neue Faktoren im mathematischen Modell untersucht, um die Auswirkungen einer anhaltenden Entzündung bei CKD sowie die Dynamik des Eisenmangels zu erfassen. Aufgrund der Komplexität der multifaktoriellen Pathophysiologie bei renaler Anämie ist ein multidisziplinärer Ansatz erforderlich, um die Schlüsselelemente der Hämodynamik bei renaler Anämie aufzuklären. Um dieses Ziel zu erreichen, wird NephrESA in fünf Arbeitspakete (AP) strukturiert, die sich auf die Hämodynamik (AP1: Prof. Dr. Jens Timmer, Universität Freiburg), Entzündung (AP2: Prof. Dr. Ursula Klingmüller, Deutsches Krebsforschungszentrum Heidelberg), Eisenstoffwechsel und Eisenmetabolismus (AP4: Prof. Dr. Martina Muckenthaler, Universitätsklinikum Heidelberg) und Thrombozytenaktivierung (AP4: Prof. Dr. Albert Sickmann, Leibniz-Institut für Analytische Wissenschaften, Dortmund) konzentrieren. Die Arbeiten werden von Prof. Dr. Tobias Huber vom Universitätsklinikum Hamburg-Eppendorf (AP5) mit Patientendaten, Patientenproben und der klinischer Konzeptualisierung unterstützt. Die Ergebnisse von AP2, AP3 und AP4 werden in das mathematische Modell von AP1 integriert und schließlich in AP5 in der klinischen Routine der Anämiebehandlung bei CKD-Patienten validiert.
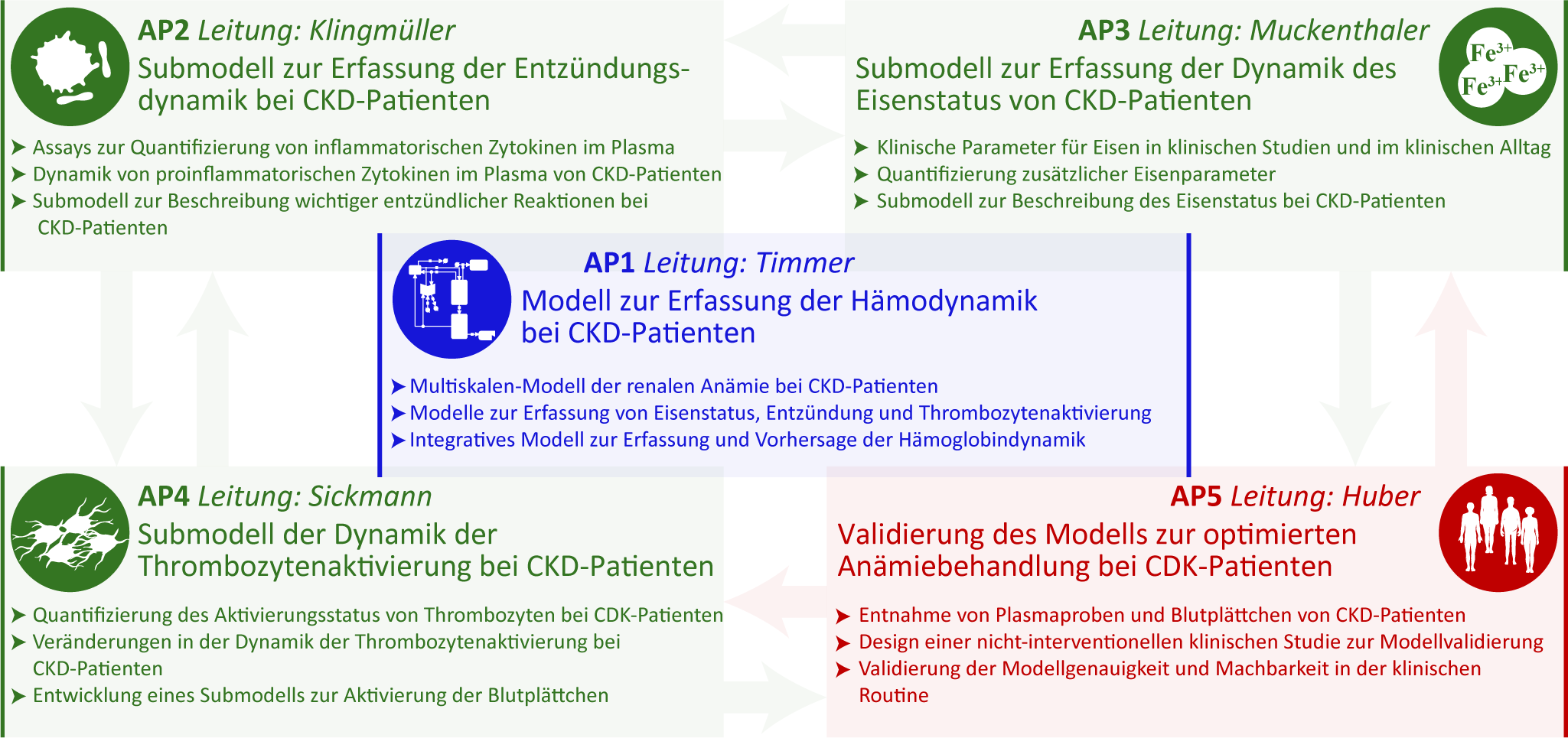
Abb. 1: Arbeitspakete und Interaktionen in NephrESA. AP1 wird von Prof. Dr. Jens Timmer an der Universität Freiburg geleitet. Prof. Dr. Ursula Klingmüller am Deutschen Krebsforschungszentrum Heidelberg ist die Leiterin von AP2. AP3 wird von Prof. Dr. Martina U. Muckenthaler am Universitätsklinikum Heidelberg geleitet. Prof. Dr. Albert Sickmann am Leibniz-Institut für analytische Wissenschaften in Dortmund ist der Leiter von AP4. AP5 wird von Prof. Dr. Tobias B. Huber am Universitätsklinikum Hamburg-Eppendorf geleitet.
Informationen zur Fördermaßnahme finden Sie auf der BMBF Webseite.



